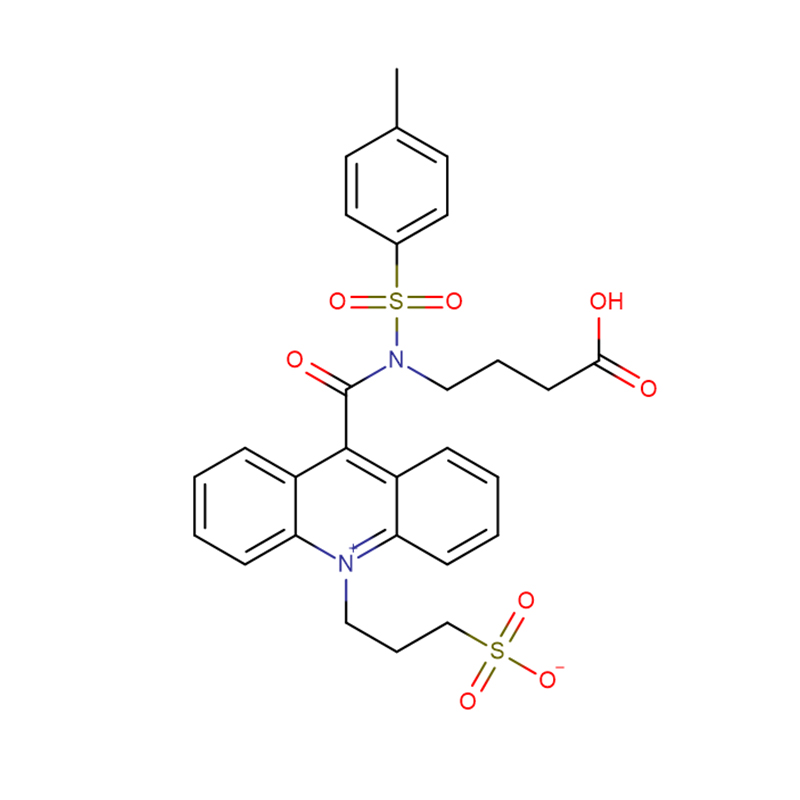
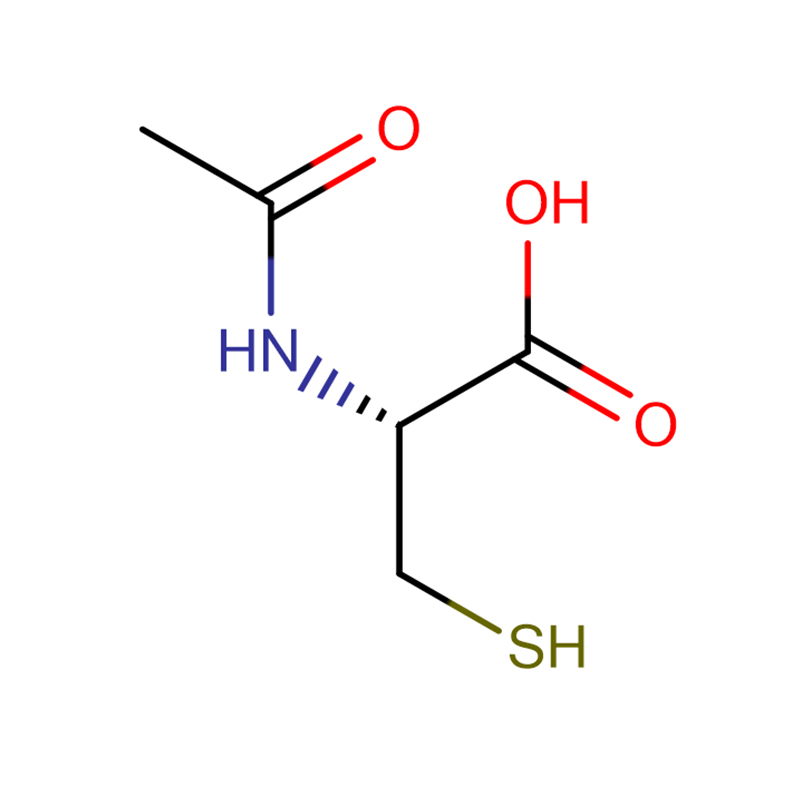
4-Amino-3-hydrazino-1,2,4-triazol-5-thiol Cas:28836-03-5 99% Žlutá až zelená pevná látka
| Katalogové číslo | XD90146 |
| jméno výrobku | 4-Amino-3-hydrazino-l,2,4-triazol-5-thiol |
| CAS | 28836-03-5 |
| Molekulární vzorec | C16H13NO3S-NH3 |
| Molekulární váha | 316,37 |
| Podrobnosti o úložišti | Okolní |
| Harmonizovaný celní kód | 2923900090 |
Specifikace produktu
| Vzhled | Žlutá až zelená pevná látka |
| Assay | ≥ 99 % |
| Bod tání | 237 °C (rozkl.) (lit.) |
| Rozpustnost | NaOH: rozpustný 1 N |
| Rozpustné ve vodě | Rozpustný ve vodě, 1N NaOH a methanolu. |
1. Studovali jsme inhibiční účinky isorhamnetinu na houbovou tyrosinázu pomocí inhibiční kinetiky a výpočetní simulace.Isorhamnetin reverzibilně inhiboval tyrosinázu způsobem smíšeného typu při Ki=0,235±0,013 mM.Měření vnitřní fluorescence a fluorescence vázající 1-anilinonaftalen-8-sulfonát (ANS) ukázala, že isorhamnetin neindukuje významné změny v terciární struktuře tyrosinázy.Pro získání náhledu na proces inaktivace byla kinetika vypočítána pomocí měření v časovém intervalu a kontinuálních reakcí substrátu.Výsledky ukázaly, že inaktivace vyvolaná isorhamnetinem byla reakcí prvního řádu s dvoufázovými procesy.Abychom získali další přehled, simulovali jsme dokování mezi tyrosinázou a isorhamnetinem.Simulace byla úspěšná (vazebné energie pro Dock6.3: -32,58 kcal/mol, pro AutoDock4.2: -5,66 kcal/mol a pro Fred2.2: -48,86 kcal/mol), což naznačuje, že isorhamnetin interaguje s několika zbytky, např. jako HIS244 a MET280.Tato strategie predikce interakce tyrosinázy v kombinaci s kinetikou založenou na flavanonové sloučenině se může ukázat jako užitečná při screeningu potenciálních přirozených inhibitorů tyrosinázy.
2. Dráha rozvíjení kyseliny konalbuminu (CA), monomerního glykoproteinu z bílku slepičího vejce, byla zkoumána pomocí spektroskopie CD vzdáleného a blízkého UV záření, vlastní fluorescenční emise, vnější fluorescenční sondy 1-anilino-8-naftalensulfonátu (ANS) a dynamický rozptyl světla (DLS).Pozorujeme změny v sekundární a terciární struktuře CA závislé na pH.Má nativní α-helikální sekundární strukturu při pH 4,0, ale ztrátovou strukturu při pH 3,0.CA existoval výlučně jako předroztavený globulární stav a roztavený globulový stav v roztoku při pH 4,0 a pH 3,0, v daném pořadí.Vliv pH na konformaci a termostabilitu CA ukazuje na jeho tepelnou odolnost při neutrálním pH.Výsledky DLS ukazují, že stav MG existoval jako kompaktní forma ve vodných roztocích s hydrodynamickými poloměry 4,7 nm.Zhášení tryptofanové fluorescence akrylamidem dále potvrdilo akumulaci mezilehlého stavu, částečně rozvinutého, mezi nativním a rozvinutým stavem.




![sodná sůl N-[[bis[4-(dimethylamino)fenyl]amino]karbonyl]glycinu Bílý až šedozelený krystalický prášek](http://cdn.globalso.com/xdbiochems/115871-19-7.jpg)