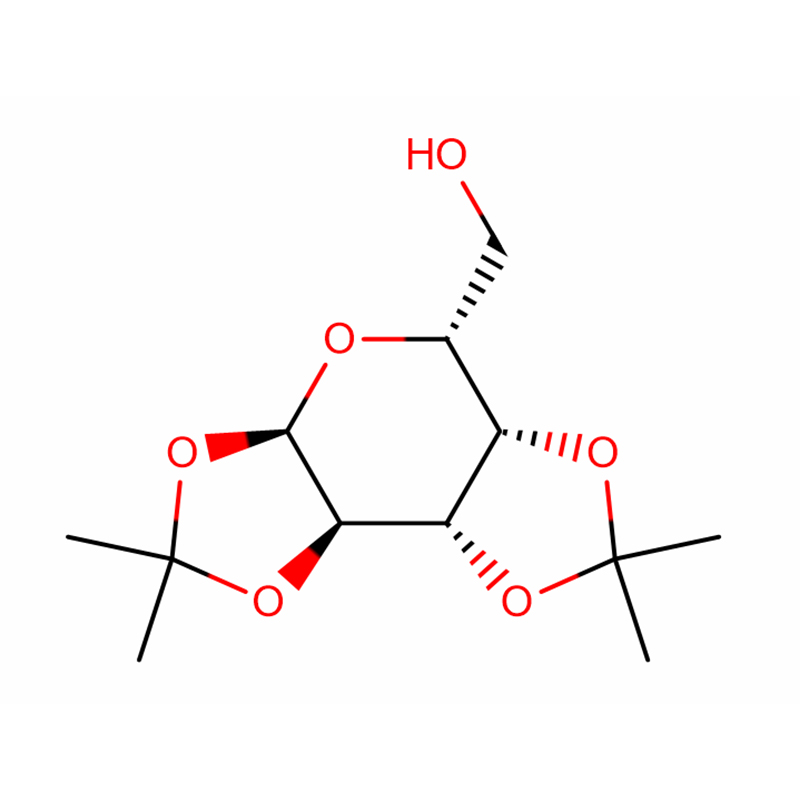
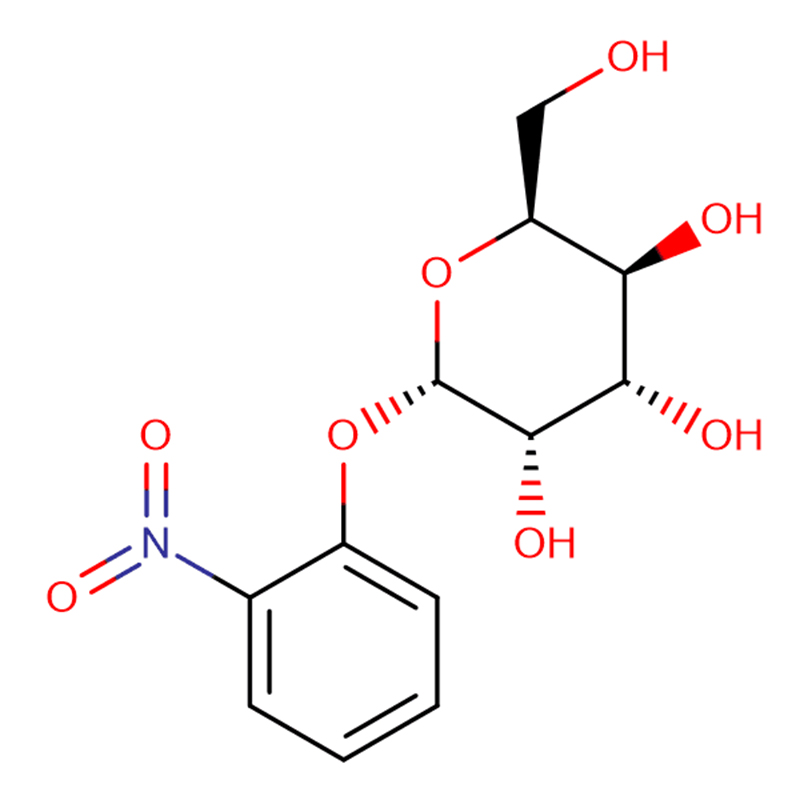
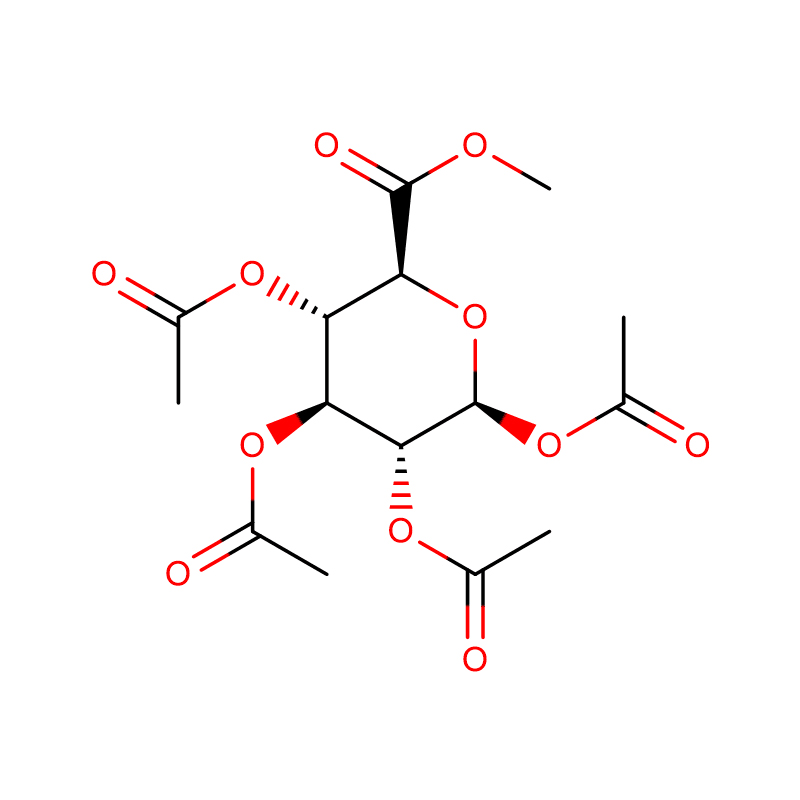
Gen beta-glukosidázy (bgl3) ze Streptomyces sp.QM-B814 (American Type Culture Collection 11238) byl klonován funkční komplementací beta-glukosidáza-negativního mutantu Streptomyces lividans.Sekvenováním byl nalezen otevřený čtecí rámec 1440 nukleotidů kódujících polypeptid o 479 aminokyselinách.Kódovaný protein (Bgl3) vykazuje rozsáhlou podobnost (přes 45% identitu) s beta-glykosidázami z glykosylhydroláz rodiny-1.Klonovaný enzym, purifikovaný po precipitaci síranem amonným a dvou chromatografických krocích, je monomerní s molekulovou hmotností 52,6 kDa, jak bylo stanoveno hmotnostní spektrometrií, a isoelektrickým bodem pí 4,4.Zdá se, že enzym je beta-glukosidáza se širokou substrátovou specifitou, je aktivní na cellooligomery a provádí transglykosylační reakce.Odhadované zdánlivé hodnoty Km pro p-nitrofenyl-beta-D-glukopyranosid a celobiózu jsou 0,27 mM a 7,9 mM, v daném pořadí.Hodnoty Ki pro glukózu a delta-glukonolakton za použití p-nitrofenyl-beta-D-glukopyranosidu jako substrátu jsou 65 mM a 0,08 mM, v daném pořadí.Purifikovaný enzym má pH optimum pH 6,5 a teplotní optimum pro aktivitu je 50 stupňů